Diamante e grafite: differenze
Il diamante è molto ricercato non solo per la sua incredibile limpidezza, proprietà capace di conferire a questo minerale il posto d’onore tra i materiali più preziosi nell’ambito della compravendita di oggetti di lusso, ma soprattutto per le sue proprietà intrinseche, quest’ultime molto apprezzate nel campo delle lavorazioni industriali. Il diamante, assieme alla grafite, costituisce una delle forme allotropiche (elementi chimici che esistono in diverse forme) del carbonio: un elemento, difatti, può esistere in due o più forme fisiche, le quali essenzialmente differiscono per il modo in cui sono legati e quindi disposti gli atomi all’interno del reticolo cristallino. Vediamo in questo articolo quali sono le differenze tra diamante e grafite, due forme dello stesso elemento che hanno però un valore commerciale sensibilmente diverso.

Le differenze tra diamante e grafite a livello fisico e chimico
Tutte le forme allotropiche del carbonio (diamante incluso) rientrano nella categoria dei solidi covalenti, ossia quei materiali caratterizzati microscopicamente dalla presenza di cristalli, all’interno dei quali è possibile osservare dei siti popolati da atomi legati gli uni agli altri attraverso l’intenso legame covalente; tale tipo di legame atomico è il più forte esistente ed ha la particolarità di non essere di natura elettrostatica, come invece avviene nel caso del legame ionico tra sodio (Na) e cloro(Cl) nel composto NaCl (sale da cucina).
L’energia necessaria a rompere i legami, cioè le forze esistenti tra gli atomi, risulta essere molto elevata, tant’è che materiali come il diamante presentano un’elevatissima temperatura di fusione e una straordinaria durezza, tanto da occupare, con quattro volte la durezza assoluta del corindone (altro minerale), il primo posto nella scala di Rosiwal (evoluzione della scala di Mohs, utilizzata per identificare la durezza di un minerale).
Resta da chiedersi perché diamante e grafite, entrambi costituiti da solo Carbonio, siano così differenti non solo nell’aspetto, ma soprattutto in termini di proprietà meccaniche.
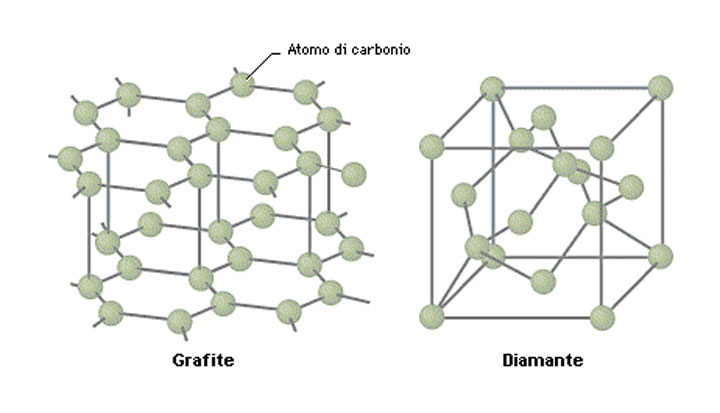
Entrambi i solidi (diamante e grafite) si differenziano principalmente nel tipo di legame covalente e nella disposizione di atomi all’interno della struttura cristallina: nel cristallo di diamante, il carbonio è disposto lungo i quattro vertici di un tetraedro e TUTTI gli elettroni sono impiegati nel formare dei legami, mentre nella grafite gli atomi di carbonio sono disposti in strati di anelli esagonali e NON tutti gli elettroni formano lo stesso tipo di legame, ma vi è una coppia di elettroni in grado di formare un debole legame in direzione perpendicolare agli strati reticolari.

Questo debole legame tra gli strati di atomi, in quella conformazione particolarmente facile da individuare grazie alla caratteristica forma esagonale, giustifica l’estrema facilità con cui la grafite si sfalda (si pensi alla mina della matita, dove scrivendo non si fa altro che lasciare strati di grafite sul foglio), mentre il diamante è utilizzato per la sua proprietà abrasive, in ogni misura derivanti dall’eccessiva durezza: per sfaccettare un diamante, infatti, è necessario usare un altro diamante.
Come nascono i diamanti
Tuttavia, la grafite può trasformarsi in diamante in determinate condizioni di temperatura e pressione, questa trasformazione vede il coinvolgimento di un processo che avviene naturalmente all’interno del mantello terrestre, dove tali grandezze raggiungono valori estremi. Una volta formatosi nelle profondità del nostro pianeta, il diamante, riaffiora nella crosta terreste grazie ai movimenti tellurici che avvengono nel corso di millenni.
E’ inoltre possibile la creazione di diamanti artificiali, ma questi ultimi sono utilizzati specialmente per le lavorazioni degli acciai particolarmente tenaci nelle macchine utensili (come tornitura o lucidatura).
E’ dunque la rarità del diamante, la sua struttura atomica, a definirne la preziosità e pertanto il maggior valore in termini economici sul mercato mondiale. Gioiellieri e orefici – che adornano collier e parure – lo sanno bene.

Pingback: Differenza tra gioielleria e oreficeria
Pingback: Differenza tra brillante, diamante e zircone
Pingback: Oro bianco e oro giallo, differenze
Pingback: Matite: un diamante tra le nostre mani. - justScience